Fyzika atomu
Model atomu
Vývoj názorů na strukturu hmoty
Vnitřní strukturou látky se zabývali jako první starořečtí atomisté - hlavním představitelem je Démokritos (460 - 370 př. n. l.) - na základě filozofických úvah (má-li si látka při postupném dělení zachovávat své vlastnosti, musí existovat hranice tohoto dělení) dospěli k představě atomu - dále již nedělitelné částice hmoty. Atomy různých látek se podle jejich představ liší velikostí a geometrickým tvarem a jsou podle nich odděleny prázdným prostorem. Tato filosofická představa vystačila vědcům téměř 2000 let.
Na počátku 19. století vyslovil svoji atomovou teorii John Dalton na základě zkoumání chemických vlastností látek - atomy nadále považoval za nedělitelné (nestvořitelné a nezničitelné), atomy různých prvků se liší hmotností a velikostí a chemické reakce spočívají v přemísťování atomů.
Nedělitelnost atomu vyvrátil objev elektronu - záporně nabité částice, která se při některých dějích uvolňovala z jinak elektricky neutrální látky (1897, sir Joseph John Thomson). Thomson navrhul model atomu na základě představy rovnoměrně rozprostřené kladně nabité hmoty a v ní rozptýlených záporných elektronů (jako "rozinky v misce anglického pudinku").
Počátkem 20. století dokázal svými pokusy Ernst Rutherford, že naprostá většina hmoty atomu je soustředěna v kladně nabitém jádře nepatrných rozměrů, záporné elektrony obíhají kolem tohoto jádra - tzv. Rutherfordův (planetární) model atomu, v roce 1919 přidal Rutherford do svého modelu představu protonu jako elementární kladně nabité částice, která se nachází v jádře.
Když v roce 1932 objevil James Chadwick v jádře atomu elektricky neutrální částici - neutron, zdálo se, že rodina elementárních částic je úplná.
Dnes víme, že elektron je skutečně elementární částicí, proton a neutron se ale skládají z dalších částic, které se nazývají kvarky (současně přijímaná představa o světě elementárních částic se nazývá Standardní model).
Elektronový obal atomu
Rovněž Rutherfordova představa planetárního modelu atomu se s dalšími objevy zpřesnila (Bohrův model) - elektrony se smí pohybovat kolem jádra pouze v jakýchsi "slupkách", "hladinách" s přesně stanovenou energií, přičemž jednu hodnotu energie smí mít nejvýše dva elektrony (tzv. Pauliho vylučovací princip):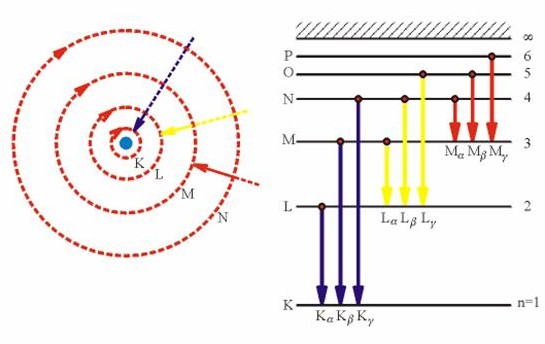
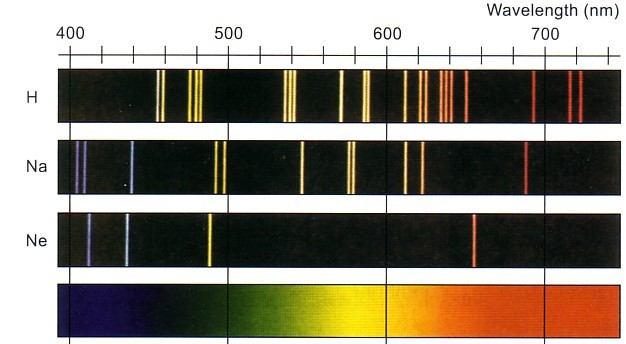
Touto teorií se vysvětluje vznik spekter - fakt, že různé atomy mohou pohlcovat pouze energii určité hodnoty, pohlcená energie se projeví přeskočením elektronu do "vyšší" slupky, při jeho návratu zpět se tato přesně stanovená energie opět vyzáří: